配合物组成与性质间的关系
配合物种类繁多、组成复杂,仅据组成来推断其结构及某些性质,是有相当难度的一件工作。但在无机化学教学的范畴内,为体现结构理论的指导意义,还是经常要涉及到的一些配合物组成及其性质间关系的讨论。更何况,这两者之间也本就有一些规律可循。
由于,用于解释配合物性质的理论有价键理论与晶体场理论之分,其讨论的角度和内容还有所差异,所以应该分两部分来研究。
一、用价键理论解释一些配合物性质
价键理论的要点实际上用两句话就可以概括出来:
第一是,中心离子提供空的杂化轨道,配体提供孤电子对,来形成配位键(σ配键)。这个键从本质上说属于共价键)。
第二是,中心离子所提供的杂化轨道,从类型上可分为sp、sp2、sp3、dsp2、sp2d、sp3d、d2sp3、sp3d2…等十来种杂化形式。但其中较为常见的杂化类型实际上只有几种。这几种杂化类型的中心离子配位数及配合物空间构型如下表所示:
这5种较常见类型中,又以直线型、平面正方形、正八面体型,这3个最为重要。因为有关配合物的中心离子的杂化类型及配位数、配合物的空间构型及几何异构体的数目、配合物属于内轨还是外轨构型及其稳定性、成单电子数及磁性等判断,多与这三个构型,尤其是八面体构型有关。
(一)配合物组成能直接提供出的信息
根据配合物组成来判断配合物性质,首要的是从配合物的化学式中获取出足够多的信息。以便将其作为分析和判断配合物性质的依据。
如对[Ag(NH3)2]+这样简单的化学式,一眼就可以看出,这是一个以Ag+为中心离子,与2个单齿配体NH3,所组成的配合物。Ag+的配位数为2。由上表可知Ag+为sp杂化,配离子为直线型。
而对[ZnCl4]2-及[Ni(CN)4]2-这样的化学式,虽然也可以知道它们中心离子的配位数都是4,但具体是sp3杂化,还是dsp2杂化或sp2d杂化,就需要用相关的理论来自行分析了。
也就是说,一般情况下,需要我们继续进行的工作有两个方面。
一是,确定与杂化类型相关的空间构型,是四面体型、还是平面正方形?
二是,即便知道了空间构型,还要判断到底是用了哪些d轨道(如上例中,是dsp2、还是sp2d)。用术语来描述,就是属于内轨型配合物、还是外轨型配合物?
配合物内、外轨型的不同,会使配离子在稳定性方面有显著差别。内轨型配合物一般比外轨型配合物要更稳定一些。
下面的讨论也主要围绕着这两方面的工作来展开。
(二)中心离子电子构型对轨道杂化类型的影响
中心离子的电子构型,关系到中心离子所能提供出的参与杂化的轨道种类和数目。作为轨道杂化的内因,它必然是一个主导因素。
而中心离子的电子构型又是由其所在的族数、及所带的电荷数决定的。所以能清楚地判断出中心离子的电子构型,是把握这个判别方法的基础。
从中心离子所能提供出的d轨道数目来看,中心离子可以分成以下的几类:
1.第一类,中心离子为d9-10电子构型的配离子。它们内层的d轨道是被本身固有的电子完全占据(每个轨道最多容纳2个电子,5个d轨道,正好可容纳9或10个电子),无法提供出空的可供杂化的d空轨道。这样,在已知配合物组成(配位数已知)时,就可以直接做出它不可能使用内层d轨道的判断。也就是说,2配位时中心离子只能是sp杂化;4配位时只能是sp3杂化。
如,[Ag(NH3)2]+中的Ag+(d10电子构型),[Cu(NH3)2]+中的Cu +(d10电子构型),都为sp杂化;
[Zn(NH3)4]2+中的Zn2+(d10电子构型),是sp3杂化。
当然,这类电子构型的离子,一般也应处于ⅠB或ⅡB的位置。
对这类配合物,不用考虑配体种类不同的影响。
2. 第二类,中心离子为d7-8电子构型的配离子。这时,要考虑配体的影响。
当配体的斥电子能力较强时,可以将电子挤入4个d轨道,而空出1个d轨道,4配位时采取的是dsp2杂化。如[Ni(CN)4]2-中的Ni2+为d8电子构型,由于CN-的斥电子能力很强,8个d电子只占据了4个d轨道,所以是dsp2杂化。配合物的未成键电子数为0,磁矩μ=0,有反磁性。相对于μ≠0的配合物,也被称为低自旋型配合物。
当配体的斥电子能力较弱时,没有能力将电子挤入4个d轨道,而不会有空的d轨道,4配位时采取的是或sp3杂化。如[NiCl4]2-中的Ni2+为d8电子构型,由于Cl-的斥电子能力较弱,8个d电子要占据了5个d轨道(有2个成单电子),所以其中心离子是sp3杂化。配合物的未成键电子数为2,磁矩μ≠0,有顺磁性,也称为高自旋型配合物。
换句话说,前者是内轨型配合物,后者属于外轨型配合物。
当6配位时,d7-8电子构型的中心离子只能采取sp3d2杂化,是外轨型配合物。
3. 第三类,中心离子为d4-6电子构型的配离子。当配体的斥电子能力较强时,可以将电子挤入3个d轨道,而空出2个d轨道,这样6配位时就是d2sp3杂化。所以也有内轨与外轨的区别。
4. 第四类,中心离子为d1-3电子构型的配离子。本身就有2个空的d轨道。其所能提供的2个空轨道与配体斥电子的能力无关,只能是d2sp3杂化。不应再作内轨与外轨之分。但配离子具有内轨型配合物的性质,有特殊的稳定性。
不难看出,只有对上面的第二和第三类中心离子(中心离子为d4-8电子构型时)的配合物,才要分析是内轨、还是外轨型,并且依据的是配体斥电子能力的大小。
(三)配体对中心离子杂化类型的影响
配体在配合物中对中心离子d电子的斥力大小,对具有d4-8电子构型中心离子的杂化类型有着至关重要的影响。配体对d电子的斥力大,就可能提供2个空的d轨道;反之,配体对d电子的斥力小,就连提供1个空d轨道的可能性也没有。为衡量配体对d电子排斥力的大小,要有一个比较定量的标准才行。
在中心离子相同的情况下,不同配体对d电子排斥力的大小,是可以通过光谱实验测得的数据,加以归纳而得到的。所得的序列称为光谱化学序。其大致的斥电子能力由小到大的序列为:
I-
-2---3---2O3<NO2--。要背住这个顺序,是比较麻烦的。
其实也没有必要。因为,在实用中相对较简单、也便于记忆的分类是:
排斥电子能力强的配体有CN-和NO2-,可称为强场配体(该实验是晶体场理论的基础,因而用到了“场”字)。其配合物 多为低自旋的内轨型,稳定性也相对较好;
排斥电子能力弱的配体有卤离子和H2O,可称为弱场配体。其配合物多为高自旋的外轨型;
排斥电子能力居中的配体为NH3。其配合物究竟是内轨、还是外轨,一般要由实验来判定。
如,由于CN-为强场配体,所以[Fe(CN)6]3-的中心离子为d2sp3 杂化,属于内轨型,有1个未成键电子、是低自旋配合物;而H2O为弱场配体,所以[Fe(H2O)6]3+的中心离子为sp3d2杂化,是外轨型配合物,有5个未成键电子。
(四)18电子规则
过渡元素的羰基(及亚硝基等)化合物,是一类比较特殊的配合物。一般只要求大家会用18电子规则(也被称为有效原子序数规则、EAN规则)来判定其某组成的稳定性。
所谓的18电子规则,就是认为,当配合物的电子数达到18时(所谓的获得稀有气体电子构型的倾向),配合物才是稳定的。即,当价电子层的9个轨道,都被电子填充满,成为(n-1)d10ns2np6结构时(9个轨道、正好被18个电子“全充满”),配合物有特殊的稳定性。
具体的计算方法为:
中心原子的价电子数 + 配体提供的电子数 + 原子团所带的电荷 = 18。
计算时要注意,每个羰基向中心离子提供2个电子;每个亚硝基向中心离子提供3个电子;每个异戊二烯基要向中心离子提供5个电子。
如,Fe(CO)5、Co(CO)4-、Ni(CO)4、Fe(C5H5)2,分别有8 + 2×5 = 18、9 + 2×4 + 1 = 18、10 + 2×4 = 18、8 + 5×2 = 18,均有18个电子。它们都满足18电子规则,因而都是稳定的结构。
不难看出,18电子规则的理论模型和能说明的问题,与价键理论多有差别。但从轨道“全满”等出发点来看,与价键理论还是有一些相似之处的,与晶体场理论的差别更大。所以将其放在价键理论部分来讨论,还是有一定的合理性。
二、用晶体场理论解释一些配合物性质
与价键理论相比较,晶体场理论有一些定量、或半定量的味道。
晶体场理论的要点为:
在某种配体电场的静电作用下,中心离子原来简并(即彼此间能量相同)的d轨道要发生分裂(向不同方向伸展的d轨道,所受到的配体的静电排斥力不同,一部分轨道能量要升高、另一部分则能量降低)。最高能量d轨道与最低能量d轨道的能量差,叫做晶体场分裂能(Δ)。
d电子在分裂后的d轨道中排布,要遵循能量最低原则。
中心离子与配体的作用具有离子键的性质。
在不同的配体场中,中心离子d电子的分裂情况是不同的。通常只要求学生掌握八面体场的情况,也就是中心离子为6配位的情况。
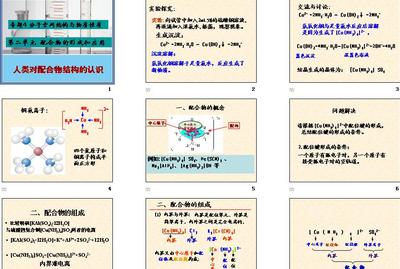
在6个配体的电场(八面体场)作用下,中心离子的d轨道分裂情况如下图所示:
分裂后的5个d轨道为两组:2个能量高的eg(简并)轨道,3个能量低的t2g(简并)轨道。
由于eg与t2g轨道间的能量差值Δ=10Dg,称为晶体场分裂能。所以相对于球形场来说,eg轨道的能量E(eg)=+6 Dg,而t2g轨道的能量E(t2g)= -4Dg(只有记住这两个数值,才能进行某些相关的计算)。
定性地比较分裂能大小,除了光谱化学序外(用于中心离子相同、配体不同的情况),还有如下的两个规律:
当配体相同时,同一金属元素高价离子比低价离子的Δ大。因为正电荷多与配体间的静电作用会更强。
当配体相同时,同族同价的金属离子,周期数越高,Δ越大。因为离子半径增大,会使静电作用更强。
(一)配离子电子构型及磁性的推断
当某些配离子的晶体场分裂能很大(配体为强场配体)或很小(配体为弱场配体)时,可以直接根据晶体场分裂来推断配离子电子构型。
这种推断有两种情况:
1.根据已知的晶体场分裂能来推断电子构型
当已知某配离子的晶体场分裂能(Δ)及电子成对能(P-电子成对时,克服相互排斥所需的能量),则可据其相互间的大小来判断其电子构型:
当Δ>P时,为低自旋;
当Δ
时,为高自旋。
如,已知[Co(NH3)6]2+中的Co2+(d7电子构型)的P=22500(cm-1),配离子的Δ=11000(cm-1)。Δ
,所以其电子要尽可能不成对(要占据eg轨道)。配离子的电子构型为t2g5eg2。有3个成单的电子,属于高自旋配合物。
又如,已知[Co(NH3)6]3+中的Co3+(d6电子构型)的P=21000(cm-1),配离子的Δ=22900(cm-1)。Δ>P,所以其电子要尽可能成对(要先把能量低的t2g轨道填满)。配离子的电子构型为t2g6eg0。无成单的电子,是低自旋配合物。
2.根据组成来推断电子构型
在无晶体场分裂能(Δ)及电子成对能(P)数据时,则只能根据配体的光谱化学序来判断。所涉及的也只能是典型的强场配体,或弱场配体。
强场配体使配合物的晶体场分裂能(Δ)显著地大,电子尽可能排入t2g轨道。
反之,弱场配体使配合物的晶体场分裂能(Δ)小,电子尽可能成单分布。
如在[Fe(CN)6]4-中的CN-为强场配体,晶体场分裂能很大,中心离子Fe2+的6个d电子,都要排在3个能量低的轨道t2g中,电子排布为t2g6eg0。因而配离子无成单电子,配离子为低自旋。
而在[Fe(H2O)6]3+中的为H2O弱场配体,晶体场分裂能很小,中心离子Fe3+的5个d电子,除排在3个能量低的轨道t2g中、还要排在能量也不很高的轨道eg上。电子排布为t2g3eg2,都是成单的电子,配离子为高自旋。
3.根据所测得的配合物磁矩来判断电子构型
由于配合物的磁矩与未成对电子数的关系,能够用公式来表述(单位为B.M.)。所以从测得的μ可以估计配合物的电子构型。
如,某铁的八面体配合的磁矩为5.10 B.M.,试判断其可能的电子构型。
试着将n分别为3、4、5代入上式,可得μ分别是3.87、4.90、5.92。显然,未成对电子数应该是4。
当中心离子为Fe2+(电子构型为d6)时,电子在分裂后轨道中的可能排布为:低自旋的t2g6eg0(未成对电子数为0),或高自旋的t2g4eg2(未成对电子数为4)。
当中心离子为Fe3+(电子构型为d5)时,电子在分裂后轨道中的可能排布为:低自旋的t2g5eg0(未成对电子数为1),或高自旋的t2g3eg2(未成对电子数为5)。
可见,只有当铁的氧化数为+2,且成高自旋配合物时,才能有4个未成对电子,并与测得的磁矩在数值上吻合。
(二)配离子稳定性的判断
晶体场稳定化能(CFSE)作为电子在分裂后的d轨道中填充时的能量降低值,可以作为衡量配合物稳定性的一种标度。晶体场稳定化能越负(放热多),配离子越稳定。
如,Co3+离子(电子构型为d6)配合物总比Fe3+离子(电子构型为d5)相应配合物稳定的分析:
在强场中,Co3+离子配合物的电子构型为t2g6eg0。CFSE=6×(-4 Dg)= -24 Dg。
在弱场中,Co3+离子配合物的电子构型为t2g4eg2。CFSE=4×(-4 Dg)+2×6 Dg =- -4 Dg。
在强场中,Fe3+离子配合物的电子构型为t2g5eg0。CFSE=5×(-4 Dg)= -20 Dg。
在弱场中,Fe3+离子配合物的电子构型为t2g3eg2。CFSE=3×(-4 Dg)+2×6 Dg = 0 Dg。
可见,无论在强场、还是在弱场中,Co3+离子配合物的CFSE都更大(不考虑负号,负号表示是放热),所以都比Fe3+离子的相应配合物稳定。
比较严格的CFSE计算,是要考虑电子成对能的。这时,
在强场中,Co3+离子配合物有3个成对的电子,CFSE= -24 Dg+3P。
在弱场中,Co3+离子配合物有1个成对电子, CFSE=- -4 Dg+P。
在强场中,Fe3+离子配合物有2个成对电子,CFSE=5×(-4 Dg)= -20 Dg+ 2P。
在弱场中,Fe3+离子配合物无成对电子,CFSE= 0Dg。
(三)对配离子颜色的解释
对配离子来说,d电子如果在分裂后的t2g与eg间跃迁(称为d-d跃迁),是要吸收能量的。而这个能量差(其实就是晶体场分裂能)恰好相当于可见光的波长,可以被人们观察到。
所以,配离子显色主要的条件是,eg轨道不能被填满(以便容纳跃迁来的电子)。
这样就很好理解,d轨道已经填满的Ag+、Zn2+的配合物为什么都没有颜色了。
而中心离子为d1-9电子构型的配合物则多有颜色。
至于某配合物为什么显这个颜色,当然与中心离子及配体都有关系。严格的说,是取决于晶体场稳定化能。但从吸收的光,到给人们的视觉感受,还要涉及物理学中光的互补规律。实在不是一个化学问题。
所以,某常见配离子具体是什么颜色,还是要靠单个地去记忆。这是必须要掌握的无机化学基本知识中的一方面内容。
参考文献
[1]北京师范大学等校. 无机化学(第三版)高等教育出版社.1992年
 爱华网
爱华网