一、金属活动性顺序表的发现
1865年,俄国学者贝开托夫(Beketob)在实验的基础上,研究了金属单质与水、酸及盐溶液间进行置换反应的速度,发表了《对某一元素为另一元素所置换的研究》论文,总结出金属活动性顺序为:
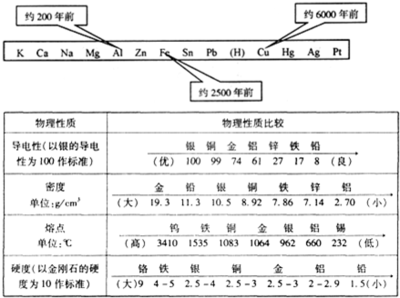
KNaCaMgZn Fe Sn Pb(H) Cu Hg Ag Pt Au
在这个顺序里,Na排在Ca的前面,这是因为Na与水反应比Ca与水反应的速率快得多。
随着科学家们对电极电势的研究,发现钙的标准电极电势(E¢)比钠的标准电极电势要小,而贝开托夫所做实验时是因为Ca与水反应时生成了微溶的Ca(OH)2阻止反应所致,按照金属在水溶液中形成低价稳定的简单离子的标准电极电势由小到大的次序,便排列成现在我们所使用的金属活动性顺序表。
人民教育出版社出版的初三《化学》关于金属活动性顺序是这样叙述的:经过长期的实践,人们总结出常见金属的化学活动性顺序如下:
K Ca NaMg Al ZnFe SnPb (H) CuHg Ag PtAu
金属活动性由强逐渐减弱
二、金属活动性顺序表在中学化学中的应用
1、判断金属活动性的强弱
金属的活动性是反映金属单质在水溶液里形成水合离子趋势的大小,也就是反映金属在水溶液里起氧化反应的难易。金属单质在水中越易形成水合阳离子,其金属性越强,反之越弱。金属单质在水溶液中失去电子的难易程度可以用标准电极电势(E¢)加以判断。金属在溶液中发生置换反应是一个复杂的过程,既包括金属原子脱离晶体表面变为气态原子,气态原子变为气态阳离子,气态阳离子再变为水合离子的过程;又包括被置换的金属由水合离子变为气态离子,气态离子得电子变为气态原子,气态原子沉积变为金属的过程。金属的电极电势就是综合考虑上述各种因素并用以表示金属活动性强弱的物理量。
在金属活动性顺序表中,越在前面的金属,其原子在水溶液中越易失去电子,还原性越强,其离子越难得到电子,氧化性越弱。从K—Au,金属活动性递减,即K是最强的还原剂,而Au3+是最强的氧化剂。
应当注意金属活动性与元素金属性的区别。元素的金属性指的是元素气态原子失去电子变成阳离子趋势的大小。判断元素金属性的定量标度是电离能,影响电离能的主要因素是原子半径、有效核电荷和电子所处的状态。元素的电离能越小,表示气态原子越易失去电子,元素的金属性越强。将各元素的第一电离能按小到大的顺序排列如下:
K Na Al CaCr Sn PbMn Ni MgAg Cu FePt Au HgH
而我们高中化学教学过程中,学生或者教师常将金属活动性和元素金属性概念混为一谈,没有加以辨析,同时教材也没有加以区别。如人教版高中《化学(必修加选修)》(第一册)对于判断元素金属性的依据这样叙述道:
元素金属性的强弱,可以从它的单质跟水(或酸)反应置换出氢的难易程度,以及它的最高价氧化物和水化物——氢氧化物的碱性强弱来判断。
2、判断金属跟水、非氧化性酸及盐溶液间的置换反应规律
2.1、金属跟水的反应
2.1.1、最活泼的金属K、Ca、Na可直接跟冷水作用,置换出水中的氢,放出H2。
如:2K+2H2O=2KOH十H2↑
2.1.2、活动性比较差的金属Mg、Al能跟热水反应,生成H2。
如:Mg+2H2O=Mg(OH) 2+H2↑
2.1.3、活动性更差的金属如Zn、Fe能跟水蒸气在高温下反应生成H2。
如:Zn+2H2O(g) Zn(OH)2+H2↑
3Fe+4H2O (g)Fe3O4+4H2↑
2.1.4、Sn及氢后面的金属不能置换出水中的氢。
2.2、金属跟酸的反应
2.2.1、跟非氧化性酸的反应
位于氢前面的金属都能跟非氧化性酸反应,置换出酸中的氢,放出H2。
如:Zn+2HCl=ZnCl2+H2↑
2.2.2、跟氧化性酸的反应
除Pt、Au以外的金属都能跟浓硝酸反应放出NO2,跟稀硝酸反应放出NO;除Ag、Pt、Au以外的金属跟浓硫酸反应放出SO2;Fe、Al等遇浓硝酸或浓硫酸发生“钝化”;Pt、Au不与浓硝酸或浓硫酸反应,但跟王水反应。
2.3、金属跟盐在溶液中的置换反应。
位于金属活动性顺序表前面的金属(Mg以后的)能把后面的金属的离子从它们的故溶液中置换出来。
例如:Fe+CuSO4=FeSO4+Cu
Cu+2AgNO3=Cu(NO3)2+2Ag
3、判断原电池的正负极
构成普通原电池的三个基本条件是:⑴、两种活动性不同的金属作电极;②、其中一种金属能与电解质溶液发生自发氧化还原反应。⑶、形成闭合回路。
选择两种金属作为原电池的电极时,位于活动顺序表左边的金属是负极,位于活动顺序表右边的金属是正极。作为原电池的电极的两种金属在金属活动性顺序表中相距越远,那么它们构成的原电池的电动势就越大。例如,Zn—Ag原电池的电动势比Zn—Cu原电池的电动势大,且在Zn—Ag原电池中Zn的反应速率也比Zn—Cu原电池中的大。
4、判断电解池中金属离子的放电顺序
用惰性电极电解溶液时,阴极发生的是还原反应,故放电顺序是按阳离子的氧化性的大小排列,在相同条件下,阳离子的氧化性的大小顺序与金属活动性顺序相反,即金属单质的活动性越弱,其对应的阳离子的氧化性就越强。而阳离子的氧化性强弱的应由电极电势来衡量,与温度、离子的浓度等有关,计算公式为:由于中学阶段知识的局限性,忽略浓度和温度的影响,常见阳离子按电极电势大小排列其放电顺序为:Ag+>Hg2+>Fe3+>Cu2+>H+(酸)>Pb2+>Sn2+>Fe2+>Zn2+>H+(水)。
5、其他方面的应用
5.1、判断金属与氧的反应规律
通常是越活泼的金属越易与氧化反应,生成的氧化物越稳定。例如,K、Ca、Na在室温下就极易与氧气反应,所以保存在煤油里;A1粉在空气中遇火花会燃烧或爆炸;Cu在空气中加热就生成CuO,而Ag、Au即使在空气中加热也不会有氧化物生成。
5.2、推断金属在自然界中的存在
金属活动性顺序表中氢前的金属呈化合状态存在于自然界中:Cu、Hg、Ag等不活动金属在自然界中部分以化合状态存在,部分以游离状态存在;而Pt、Au仅呈游离状态存在。
5.3、确定金属的冶炼方法
5.3.1、从K—A1,可用电解熔融其化合物的方法。
5.3.2、从Zn—Cu,则可用C、CO、H2、A1等还原剂在加热或高温下还原该金属的氧化物。
5.3.3、Hg、Ag可用加热法使它们的氧化物分解。
5.4、判断硝酸盐的分解产物
5.4.1、K、Ca、Na的硝酸盐受热分解,生成亚硝酸盐和氧气。
如:2KNO3=2KNO2+O2↑
5.4.2、从Mg—Cu的硝酸盐受热分解生成高价金属氧化物、NO2和O2。
如:2Cu(NO3)2=2CuO+4NO2↑+O2↑
5.4.3、Hg—Au的硝酸盐受热分解生成金属单质、NO2和O2。
如:2AgNO3=2Ag+2NO2↑+O2↑
三、运用金属活动性顺序表时应注意的问题
1、金属活动性顺序一般只适用于在水溶液体系中金属单质与其他非氧化性金属离子或非氧化性酸间的置换反应。
首先,反应必须在水溶液中进行。
例如,按照金属活动性顺序,在水溶液中,金属钠不能置换出KCl中的钾,但在高温(760~880℃)熔融状态下,金属钠可以把比其活泼的金属钾从钾盐中置换出来。反应方程式为:
Na十KCl =NaCl十K↑
这是由于在熔融状态时,钾的挥发性大于钠,同时NaCl比KCl更稳定,因而使平衡向右移动。
其次,发生的反应必须是置换反应。
如果金属单质与盐溶液或酸之间发生非置换反应,则就不能用金属活动性顺序判断其进行的方向和产物。例如应用金属活动性顺序可以判定Cu不能与FeCl2溶液发生置换反应,但Cu能跟FeCl3溶液发生氧化还原反应:
Cu+2FeCl3=CuCl2+2FeCl2
又如,位于金属活动性顺序表中氢后面的铜与稀硫酸不能反应,但与强氧化性的浓硫酸(或硝酸)能反应:
Cu+2H2SO4(浓)=CuSO4+SO2↑+2H2O
Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O
2、金属活动顺序表不适用于活泼金属(K、Ca、Na、Mg)与易水解的金属阳离子间的反应。
这是由于这些活泼金属能与冷水反应使溶液呈碱性,从而促进了水解反应的进行。因此发生的不是置换反应。
如:CuCl2+2H2O+2Na=Cu(OH)2↓+2NaCl+H2↑
3、金属活动性顺序只从热力学角度上指出反应进行的可能性,而没有考虑动力学方面有关因素的影响,即没有指出反应进行的可行性。
例如:按金属活动性顺序,Sn、Pb与稀盐酸反应置换出氢是完全可能的。但实际上反应速度极慢。其原因是多方面的,主要是动力学方面的因素限制。这是因为氢的超电势的影响,在Sn和Pb的表面阻力较大,表现为过电位高,所以反应速度很小。
而现在许多中学资料或教师常引导学生从金属单质与水或酸的反应速率或剧烈程度来分析推断金属的活动性,从严格意义上讲,这是不科学的。因为金属活动顺序表是按标准电势来排列的,仅表明反应进行的趋势和程度,而反应速率是从热力学角度表明反应进行的快慢,两者没有必然的联系。
4、金属的纯度及金属的表面状态,也是影响其活动性的重要因素
例如,由Zn和Fe组成原电池,Zn是原电池的负极,理论判断和实验事实完全符合金属活动性顺序的。但如果用Al和Zn组成原电池,由金属活动性顺序判断,Al应是负极,但实验结果证明Zn是负极。造成这种反转的原因是由于Al的表面生成了氧化膜。由于氧化膜是电的绝缘体,尽管很薄,但由于它的覆盖使Al的电极电位由一1.67V提高到0.5V。又如,按金属活动性顺序判断,粗粒的纯金是不溶解于盐酸的。但是胶体状态的金却可以溶解在盐酸中。这是因为胶体状态的金具有巨大的表面能,使反应得以发生。
参考文献
[1]陶亚奇等.正确理解与探究金属的活动性顺序.化学教育,2003,6:36,42
[2]人民教育出版社化学室编著.高中化学(第一册).北京:人民教育出版社,2003
[3]人民教育出版社化学室编著.九年制义务教育三年制初级中学教科书化学(全一册) .北京:人民教育出版社,1995
[4] 武汉大学,吉林大学等编.无机化学.第三版.北京;高等教育出版社 爱华网
爱华网